心力衰竭已被公认为全球性流行病, 尽管针对终末期心力衰竭患者已有多种治疗方案,但心脏移植(HT)仍是目前最有效的治疗手段。减轻心肌缺血再灌注(IR)损伤,对于提高心脏移植的成功率、改善患者预后至关重要。在心脏移植过程中,浸润的中性粒细胞受到多种其他细胞类型的调控与影响,通过过度释放中性粒细胞胞外陷阱(NETs),进一步加剧心肌IR损伤。尽管如此,中性粒细胞与其他非心肌细胞之间相互作用的精确机制尚不明确。
武汉大学人民医院夏中元教授团队在Advanced Science(IF 14.1)上发表了题为“Inhibition of Macrophage ARID3A Alleviates Myocardial Ischemia-Reperfusion Injury After Heart Transplantation by Reducing THBS1/CD47 Signaling-Mediated Neutrophil Extracellular Traps Formation”的研究论文,结果表明THBS1/CD47信号通路是介导M1型巨噬细胞与NETs相关中性粒细胞之间相互作用的关键桥梁,4-辛基衣康酸酯(4-OI)有望成为治疗心脏移植后心肌缺血再灌注损伤的潜在治疗候选药物。

· 维真助力 - 腺病毒·
基因信息
THBS1:血小板反应蛋白-1
ARID3A:富含AT结构域的相互作用蛋白3A
CD47:整合素相关蛋白CD47
病毒产品及感染细胞
Ad-THBS1、 Ad-ARID3A(THP-1细胞)
Ad-CD47(HL-60细胞)
MOI 50
感染时间 12h
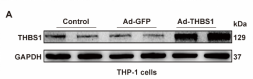
WB证实腺病毒介导基因成功过表达


研究结果
1、M1巨噬细胞通过THBS1/CD47轴诱导NETosis
作者发现心脏移植患者术后血清中MPO-DNA复合物(NETs标志物)水平显著上升,中性粒细胞更容易被诱导产生NETs,并且NETosis与HT患者心肌IR损伤的发生密切相关;利用小鼠颈部异位心脏移植模型和心肌细胞缺氧复氧(H/R)模型在体内外探究了HT再灌注损伤的病理生理学,发现NETs是心脏移植后心肌IR损伤的关键介质,靶向NETs形成是潜在治疗方向。为明确产生NETs的中性粒细胞类型,研究团队对移植心脏的非心肌细胞进行了scRNA-seq分析,DEGs分析确定了9个细胞亚群,并发现Ero1l+中性粒细胞亚群NETs评分最高,定义为“NETs相关中性粒细胞”,与HT后心肌IR损伤诱导的NETs密切相关。进一步的研究表明HT后心肌IR损伤过程中Ero1l+中性粒细胞NETs的形成与M1巨噬细胞密切相关。作者分析了巨噬细胞驱动的配体-受体对,发现THBS1-CD47的差异在M1巨噬细胞亚群和Ero1l+中性粒细胞之间很明显。免疫共沉淀实验证表明,与对照组相比,IR组中THBS1和CD47之间的相互作用显著增加。M1巨噬细胞是HT后THBS1分泌的来源之一,巨噬细胞可以通过产生THBS1介质来诱导中性粒细胞CD47激活和NETs表型,加剧IR损伤。
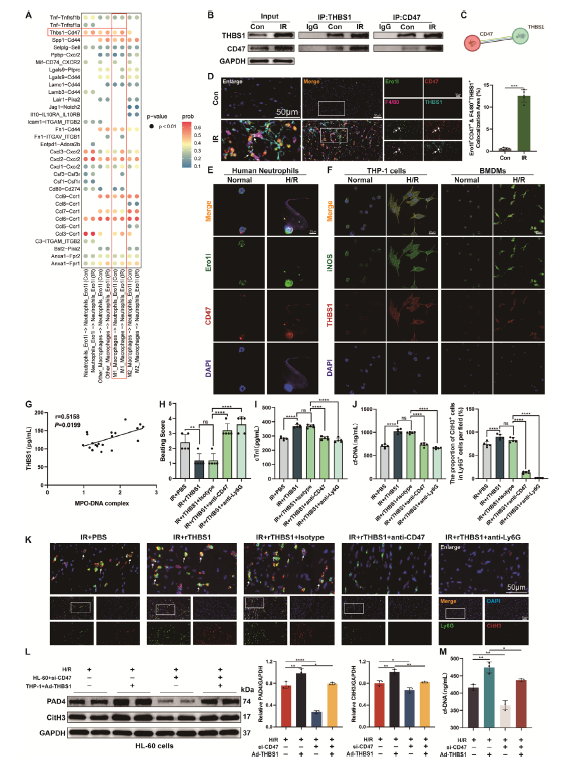
图1. M1巨噬细胞通过THBS1/CD47轴诱导NETosis
2、ARID3A在转录水平调节M1巨噬细胞中THBS1的表达
作者通过机制研究发现CD47在心肌IR期间通过调节p38 MAPK信号通路的激活来促进NETosis,为探索THBS1在M1巨噬细胞中的调控机制,利用PYSCENIC在单细胞水平上鉴定了在M1巨噬细胞亚群中特异激活的转录因子,发现ARID3A是M1巨噬细胞中显著上调的转录因子,并通过双荧光素酶报告基因测定和染色质免疫沉淀 (ChIP) 分析等证实了ARID3A直接结合HBS1启动子的P2区域并驱动其转录。进一步探讨ARID3A在H/R损伤诱导THBS1中的作用,作者使用腺病毒(Ad-ARID3A)在 THP1 细胞中过表达ARID3A,过表达ARID3A的巨噬细胞在H/R上清刺激下THBS1分泌和表达显著增加;同时,在髓系特异性ARID3A敲除小鼠中表现出减轻的心肌损伤和NETs水平,也证实了ARID3A驱动HT后心肌IR损伤诱导的M1巨噬细胞中THBS1 的转录。进一步研究发现ARID3A通过THBS1/CD47信号通路调节HT后NETs的形成和心肌IR损伤。
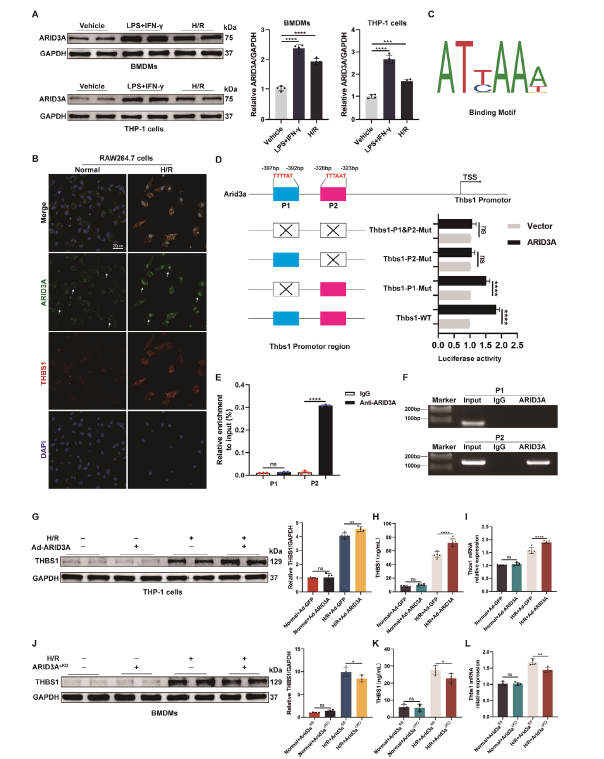
图2. ARID3A在转录水平调节M1巨噬细胞中THBS1的表达
3、4-OI可以靶向巨噬细胞中的ARID3A发挥治疗作用
代谢物衣康酸和衣康酸衍生物已表现出抑制巨噬细胞炎症反应的优异特性,作者分析了衣康酸衍生物4-OI在HT期间心肌IR损伤中的作用,发现外源性给予4-OI可以通过抑制HT期间M1巨噬细胞极化和NETosis来减轻心肌IR损伤。ARID3A是4-OI的直接靶点,4-OI 呈浓度依赖性抑制H/R上清诱导的巨噬细胞ARID3A表达,同时降低THBS1分泌,表明4-OI可能主要通过ARID3A依赖性机制发挥其心脏保护作用。此外,THP-1细胞中ARID3A的过表达,能通过增加THBS1表达来逆转4-OI对NETosis的抑制作用。已有证据表明,4-OI可以通过激活核红细胞2相关因子2 (NRF2) 信号通路发挥心脏保护作用,从而促进巨噬细胞极化并减少炎症。作者进一步评估了外源4-OI治疗是否会在H/R期间诱导 THP-1细胞中NRF2激活,发现ARID3A的过表达逆转了4-OI对NRF2/HO-1通路的激活。综上4-OI对心脏保护作用,不仅与限制THBS1/CD47通路的激活有关,还与抗氧化因子NRF2在巨噬细胞中的积累有关。
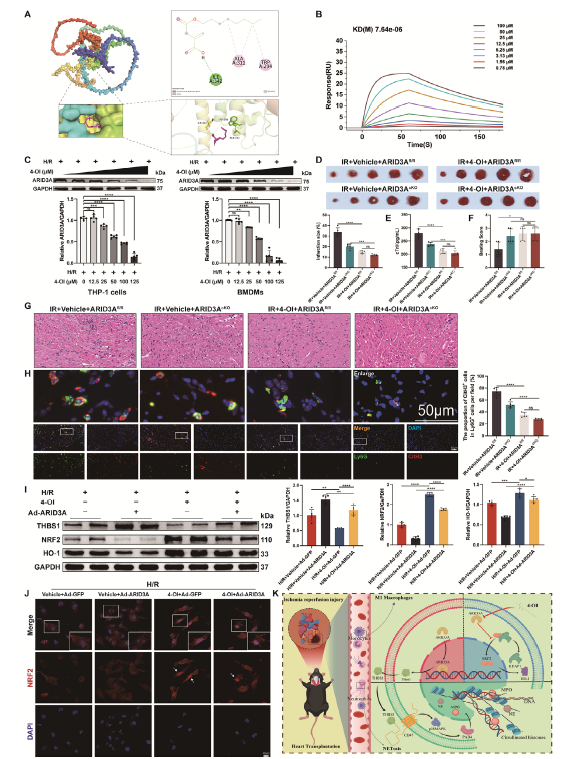
图3. 4-OI可能靶向巨噬细胞ARID3A发挥治疗作用
小结
本研究证明巨噬细胞ARID3A通过调节THBS1/CD47轴诱导HT后NETs的产生和心肌IR损伤,为4-OI对HT心肌IR损伤的保护作用提供了有力的证据。
